10.11. PHƯƠNG PHÁP PHÂN TÍCH
ACID AMIN
Phương pháp phân tích acid
amin là phương pháp xác định thành phần và hàm lượng
các acid amin trong các protein và peptid, cũng như trong các
chế phẩm thuốc. Phương pháp phân tích acid amin được
áp dụng để định tính và định lượng
các protein và peptid dựa trên các cấu tử acid amin tạo
ra chúng, để giúp việc xác định cấu trúc
của các protein và peptid cũng như việc xác định
cách phân đoạn của chúng nhằm thiết lập
giản đồ peptid và để phát hiện các acid amin
không điển hình có thể có mặt trong một protein
hoặc peptid.
Trước khi phân tích acid amin
trong protein hoặc peptid, cần thiết phải thủy
phân protein hoặc peptid thành các acid amin. Sau đó tiến hành
phân tách các acid amin thu được giống như khi ta
phân tách các acid amin tự do có trong các chế phẩm
thuốc. Điều quan trọng là chúng phải được
biến đổi thành các dẫn chất thích hợp cho
việc phân tách và phát hiện.
Thiết
bị
Các phương pháp để
phân tích acid amin thường dựa trên việc tách các acid
amin có trong mẫu thử bằng phương pháp sắc
ký. Các thiết bị sắc ký tự động thường
chiếm lợi thế. Thiết bị phân tích acid amin điển
hình là một máy sắc ký lỏng áp suất thấp
hoặc áp suất cao, có khả năng thực hiện chương
trình dung môi để tách các acid amin khi qua cột sắc ký.
Máy cần có thêm thiết bị điều chế dẫn
chất acid amin sau cột. Để phát hiện kết
quả, thường dùng detector hấp thụ tử
ngoại - khả kiến hoặc detector huỳnh quang, tùy
thuộc vào cách điều chế dẫn chất đã áp
dụng. Một thiết bị tích phân cho phép chuyển đổi
tín hiệu tương tự đi từ detector ra và cho
phép định lượng.
Các máy chuyên dùng để phân
tích acid amin thường được ưa dùng.
Chú
ý
Nhiễu đường
nền luôn là mối quan tâm của người tiến hành
phân tích acid amin. Để khắc phục, phải dùng các
thuốc thử có độ tinh khiết cao (thí dụ acid
hydrocloric có độ tinh khiết thấp có thể gây
nhiễm glycin). Thông thường cách một vài tuần
lại phải thay mới các thuốc thử. Chỉ dùng
các dung môi dùng cho sắc ký lỏng cao áp. Lọc lại các
dung môi trước khi dùng để giảm thiểu
sự nhiễm khuẩn và các tạp chất. Đậy
kín các bình đựng dung môi. Không để các thiết
bị phân tích acid amin tiếp xúc trực tiếp với tia
sáng mặt trời.
Chất lượng thực
hành phòng thí nghiệm có thể quyết định chất
lượng phân tích acid amin. Giữ phòng thí nghiệm
sạch sẽ. Đặt thiết bị phân tích trong phòng
thí nghiệm tại chỗ riêng biệt, ít bị ảnh hưởng
của các hoạt động khác. Định kỳ
rửa sạch và chuẩn hóa lại các pipet. Bảo
quản đầu pipet trong hộp đậy kín. Không được
cầm đầu piped bằng tay trần, phải mang găng
tay bằng cao su không xoa bột talc hoặc có chất lượng
tương đương. Hạn chế số lần
mở và đóng bình đựng mẫu thử vì bụi có
thể làm gia tăng kết quả về hàm lượng
các chất glycin, serin và alanin.
Cần bảo dưỡng
tốt thiết bị phân tích acid amin để có kết
quả chấp nhận được. Nếu thiết
bị được dùng thường ngày thì hàng ngày
phải kiểm tra độ rò rỉ dung môi của
thiết bị, độ ổn định của đèn
và detector, độ phân giải của cột.
Định kỳ làm sạch
hoặc thay thế các kính lọc của thiết bị và
các linh phụ kiện cần bảo dưỡng khác.
Các
chất đối chiếu
Trên thị trường có
sẵn các acid amin chuẩn để dùng trong phân tích acid
amin; chúng thường là hỗn hợp các acid amin chuẩn
trong nước. Khi cần xác định thành phần acid
amin trong một mẫu thử, các protein hoặc peptid
chuẩn phải được phân tích song song với
mẫu thử để kiểm tra sự toàn vẹn
của thử nghiệm. Trong trường hợp này,
chuẩn protein được sử dụng là albumin
huyết thanh bò tinh khiết cao.
Chuẩn
hóa thiết bị
Việc chuẩn hóa thiết
bị phân tích acid amin được thực hiện
bằng cách phân tích một chuẩn acid amin, gồm hỗn
hợp các acid amin chuẩn đã biết trước hàm lượng
của từng chất, để xác định hệ
số đáp ứng và khoảng tuyến tính ứng
với mỗi một acid amin chuẩn đã thử.
Pha loãng mẫu chuẩn acid
amin thành nhiều dung dịch có nồng độ khác nhau,
nằm trong khoảng tuyến tính dự đoán trước
của các acid amin có trong mẫu chuẩn. Tiến hành phân
tích nhiều lần với mỗi nồng độ.
Biểu thị kết quả thu được trên
biểu đồ thể hiện tương quan giữa
diện tích pic thu được ứng với mỗi
nồng độ của acid amin đã thử. Nhờ
biểu đồ này, có thể xác định được
khoảng tuyến tính của mỗi acid amin, tại đó,
các diện tích pic thu được có tương quan
xấp xỉ tuyến tính với các nồng độ
của các acid amin đã thử. Khi phân tích acid amin, để
có kết quả đúng và lặp lại, điều quan
trọng là phải pha và thử nghiệm trên các mẫu
thử có nồng độ nằm trong khoảng tuyến
tính tương ứng với kỹ thuật phân tích đang
áp dụng.
Để xác định
hệ số đáp ứng cho mỗi acid amin, ta phân tích 4 -
6 nồng độ của acid amin chuẩn tương
ứng. Hệ số đáp ứng tính được là
giá trị trung bình của diện tích pic (hoặc của
chiều cao pic) ứng với nồng độ 1 nanomol
của dung dịch acid amin chuẩn. Thiết lập
một dãy chuẩn hóa bao gồm hệ số đáp
ứng tương ứng của các acid amin và sử
dụng dãy này để tính nồng độ (nanomol)
của mỗi acid amin có trong mẫu thử bằng cách chia
diện tích pic (hoặc chiều cao pic) thu được
của acid amin đó cho hệ số đáp ứng tương
ứng có trong dãy chuẩn hóa.
Trong việc phân tích thường
ngày, khi dùng dãy chuẩn hóa, ta chỉ cần xác định
một diện tích pic là đủ. Tuy nhiên, dãy chuẩn hóa
này phải thường xuyên được thử lại
bằng các phân tích kiểm tra và được cập
nhật để bảo đảm tính toàn vẹn của
nó.
Độ
lặp lại
Muốn có các kết quả
phân tích acid amin có chất lượng ổn định
tại một phòng thí nghiệm phân tích, cần quan tâm đến
độ lặp lại của phép định lượng.
Cần có một hệ thống thiết bị phân tích các
acid amin có khả năng cung
cấp các giá trị lặp lại của thời gian lưu
của pic (để định tính) và các giá trị
lặp lại của diện tích pic (để định
lượng). Cách xác định tiêu biểu độ
lặp lại bao gồm việc pha chế một dung
dịch chuẩn các acid amin, rồi tiến hành đo
mẫu đó nhiều lần (6 lần hoặc nhiều hơn).
Sau đó, tính độ lệch chuẩn của các giá
trị thời gian lưu và độ lệch chuẩn các
giá trị diện tích pic đã được tích phân,
ứng với mỗi acid amin đã được phân tích.
Việc xác định độ lặp lại còn được
mở rộng bằng cách nhiều người phân tích khác
nhau cùng tiến hành xác định độ lặp lại
đó trong nhiều ngày. Người ta còn thực hiện
việc định lượng nhiều dung dịch có
nồng độ khác nhau của chuẩn gốc để
xác định sự biến thiên do việc pha chế
mẫu thử. Thường người ta phân tích thành
phần acid amin của một protein chuẩn (Ví dụ
albumin huyết thanh bò) để đánh giá độ
lặp lại. Nhờ việc xác định độ
lệch chuẩn, ta có thể thiết lập các giới
hạn phân tích để đạt kết quả tốt,
với độ lệch chuẩn thấp nhất. Để
giảm bớt sai số trong phân tích, nhiều yếu
tố cần được quan tâm và xem xét đầy đủ
như: cách chuẩn bị mẫu thử, nhiễu đường
nền do chất lượng của các thuốc thử,
việc thực hành thí nghiệm, tính năng và việc
bảo dưỡng máy móc thiết bị, các dữ
liệu phân tích và cách biện giải và cuối cùng
việc thực thi thành thạo của người làm phân
tích.
Chuẩn
bị mẫu thử
Muốn có kết quả phân
tích acid amin đúng, phải dùng các mẫu thử protein và
peptid đã tinh chế. Các tạp chất như các muối,
ure, chất tẩy rửa... có thể gây nhiễu, nên
cần phải loại khỏi mẫu thử trước
khi tiến hành phân tích. Phương pháp điều chế
dẫn chất sau cột sắc ký không bị nhiễm
bởi các tạp chất ở mức độ lớn như
khi điều chế dẫn chất trước cột
sắc ký. Nên giảm số thao tác trên mẫu thử để
giảm nhiễu đường nền, tăng kết
quả tìm thấy và giảm công lao động. Các cách thông
thường để loại tạp chất trong mẫu
thử protein bao gồm:
- Tách bằng sắc ký
lỏng cao áp pha đảo, thu protein bằng một dung môi
bay hơi có chứa một lượng thích hợp thành
phần hữu cơ rồi làm khô bằng ly tâm chân không,
- Thẩm tách loại bỏ tạp
chất,
- Ly tâm siêu lọc,
- Kết tủa protein bằng
một dung môi hữu cơ (ví dụ aceton),
- Lọc qua gel.
Chất
chuẩn nội
Cần dùng một chất
chuẩn nội để kiểm soát những mất mát
và biến đổi lý hóa học xảy ra trong quá trình phân
tích acid amin. Do đó, trước khi tiến hành thủy
phân phải thêm một lượng chính xác chuẩn nội
vào dung dịch protein cần phân tích. Lượng chuẩn
nội tìm thấy được sẽ là một thông
số chung cho lượng tìm thấy được
của các acid amin có trong protein. Tuy nhiên các acid amin tự do
và các acid amin liên kết trong cấu trúc protein không giống
nhau về tốc độ thủy phân hoặc phân
hủy. Vì vậy việc dùng chuẩn nội để
chỉnh lý sự mất mát trong quá trình thủy phân có
thể cho kết quả không đáng tin cậy. Cần chú
ý điều này khi biện giải kết quả phân tích.
Ta còn có thể thêm chuẩn nội vào hỗn hợp các acid
amin sau khi đã được thủy phân để
chỉnh lý những sai lệch về kết quả phân
tích gây ra do các sai lệch khi tiêm mẫu, do thay đổi độ
ổn định của thuốc thử cũng như
tốc độ dòng của dung môi. Chất chuẩn
nội lý tưởng là một acid amin bậc nhất nhân
tạo, có sẵn trên thị trường với giá
rẻ. Chất này phải bền vững trong quá trình
thủy phân, có hệ số đáp ứng tuyến tính
với nồng độ và phải được rửa
giải cho một pic có thời gian lưu độc
nhất và được phân giải tốt với các pic
tương ứng với các acid amin khác. Các chuẩn
nội thường được dùng bao gồm norleucin,
nitrotyrosin và acid α-aminobutyric.
Thủy
phân protein
Cần thiết phải
tiến hành thủy phân các mẫu thử protein và peptid trước
khi phân tích các acid amin tạo thành. Để tránh sai kết
quả, các đồ thủy tinh dùng trong thủy phân
phải hết sức sạch. Dấu vân tay trên ống
thủy phân hoặc bột tách ra từ bao tay cũng có
thể làm nhiễm bẩn mẫu thử. Để rửa
sạch các ống thủy tinh dùng trong thủy phân (ống
thủy phân), ta đun sôi chúng 1 giờ trong acid hydrocloric 1 M hoặc
ngâm chúng trong acid nitric đậm đặc hoặc trong
hỗn hợp đồng thể tích acid hydrocloric và nitric đậm
đặc. Sau đó tráng sạch bằng nước
cất tinh khiết cao, tiếp đến bằng methanol
dùng trong sắc ký lỏng cao áp. Cuối cùng sấy qua đêm
trong tủ sấy rồi bảo quản kín cho đến
khi dùng. Cũng có thể nung đồ thủy tinh dùng để
thủy phân ở nhiệt độ 500 °C trong 4 giờ để
tránh nhiễm bẩn. Cũng có thể sử dụng
loại dụng cụ thích hợp, chỉ dùng một
lần rồi bỏ.
Thủy phân bằng acid là phương
pháp thông dụng nhất để thủy phân một
mẫu thử protein trước khi tiến hành phân tách các
acid amin tạo ra mẫu thử đó. Thủy phân bằng
acid có thể cho kết quả phân tích thay đổi vì
một số acid amin bị phân hủy một phần hay
hoàn toàn. Cụ thể là: Tryptophan bị phân hủy, serin và
threonin bị phân hủy một phần, methionin có thể
bị oxy hóa còn cystein thì chuyển đổi thành cystin (tuy
nhiên lượng cystin tìm thấy được thường
thấp hơn thực tế vì một phần bị phân
hủy hoặc bị khử
trở lại thành cystein). Có thể giảm thiểu
sự phân hủy do bị oxy hóa bằng cách tiến hành
thủy phân trong môi trường chân không thích hợp (áp
suất thấp hơn 200 µm thủy ngân hoặc 26,7 Pa)
hoặc bằng cách nạp một khí trơ (argon) vào
khoảng trống phía trên của bình phản ứng. Các đường
nối peptid giữa isoleucin - isoleucin, valin - valin, isoleucin -
valin và valin - isoleucin chỉ có một phần được
cắt đứt để giải phóng acid amin thôi. Asparagin
và glutamin đều bị khử amid để thành acid
aspartic và acid glutamic tương ứng. Vì tryptophan, asparagin
và glutamin bị mất mát trong khi thủy phân bằng acid
nên ta chỉ còn định lượng được 17
acid amin. Một số kỹ thuật thủy phân mô tả
sau đây sẽ đề cập cách khắc phục các
trở ngại nêu trên. Tuy nhiên một số kỹ
thuật (từ số 4 đến số 11) lại có
thể biến đổi một số acid amin khác. Vì
vậy cần cân nhắc lợi hại khi chọn kỹ
thuật thủy phân protein/peptid và phải thực
nghiệm thích hợp trước khi chọn một kỹ
thuật thủy phân khác kỹ thuật thủy phân
bằng acid.
Thường hay dùng phương
pháp phân tích acid amin theo chương trình thời gian thủy
phân (tức là phân tích acid amin ở các thời điểm
thủy phân là 24 giờ, 48 giờ và 72 giờ) để
xác định nồng độ ban đầu của các
acid amin dễ bị phân huỷ hoặc chậm bị phân tách khi
thủy phân: Vẽ đồ thị biểu thị sự
liên quan giữa nồng độ thu được
của acid amin dễ bị phân hủy (thí dụ serin,
threonin) với thời gian thủy phân rồi ngoại suy
tới điểm gốc thời gian, ta sẽ được
nồng độ ban đầu (nồng độ ở
gốc thời gian ) của acid amin dễ bị phân
hủy đó. Áp dụng phương pháp chương trình
thời gian thủy phân này cho các acid amin chậm được
phân tách (ví dụ isoleucin và valin), trên đồ thị
sẽ có một đoạn bằng (đoạn thẳng
nằm ngang) ứng với nồng độ của acid
amin cần phân tích đó. Nếu thời gian thủy phân quá
dài, nồng độ của các acid amin cần phân tích
sẽ bắt đầu giảm, chứng tỏ acid amin đó
đã bị phân hủy do điều kiện thủy phân.
Một cách khác của phân tích
acid amin theo chương trình thời gian thủy phân được
chấp thuận là cho một chuẩn acid amin trải qua
cùng các điều kiện như khi thủy phân mẫu
thử protein/peptid. Acid amin chuẩn, ở thể tự do,
có thể sẽ không có kết quả hoàn toàn tiêu biểu
cho tốc độ phân hủy của các acid amin dễ
bị phân hủy có trong
mẫu thử protein/peptid. Điều này đặc
biệt đúng đối với các liên kết peptid
chậm bị phân tách (như liên kết isoleucin - valin). Tuy
nhiên cách phân tích này sẽ cho phép giải thích một vài trường
hợp phân hủy acid amin trong mẫu thử.
Cách thủy phân bằng acid
trong lò vi sóng cũng đã được sử dụng,
cho kết quả nhanh chóng nhưng đòi hỏi thiết
bị đặc biệt và cần thận trọng đặc
biệt. Phải xác định được các điều
kiện thủy phân trong lò vi sóng tối ưu cho mỗi
mẫu thử protein/peptit riêng biệt. Thủy phân trong lò
vi sóng chỉ cần thời gian ít phút, nhưng nếu
chỉ thêm hoặc bớt một phút so với yêu cầu
thôi cũng sẽ có thể có kết quả sai lệch
(hoặc do các acid amin dễ bị phân hủy sẽ bị
phân hủy hoặc do mẫu thử chưa được
thủy phân hoàn toàn).
Cách thủy phân hoàn toàn
bằng một hỗn hợp các men protease cũng được
áp dụng nhưng phức tạp, đòi hỏi phải được
kiểm soát chặt chẽ và thường được
áp dụng nhiều để phân tích các peptid hơn là các
protein.
Khi tiến hành phân tích lần đầu
một mẫu thử protein mới, cần phải làm
thực nghiệm để xác định các điều
kiện tối ưu về thời gian và nhiệ độ
thủy phân.
Kỹ thuật thủy phân 1
Thủy phân bằng acid
hydrocloric có chứa một lượng phenol là kỹ
thuật thông dụng nhất để thủy phân mẫu
thử protein/peptid trước khi tiến hành phân tích acid
amin. Thêm phenol vào môi trường thủy phân cốt để
ngăn ngừa hiện tượng halogen hóa tyrosin.
Dung
dịch thủy phân: Acid hydrocloric 6 M chứa từ 0,1% đến 1% phenol.
Thủy
phân pha lỏng:
Cho vào ống thủy phân mẫu thử protein/peptid rồi
làm khô (để loại nước, tránh pha loãng dung
dịch thủy phân). Cứ 500 µg mẫu thử đông khô,
ta thêm 200 µl dung dịch thủy phân. Làm lạnh ống
thử trong aceton đông băng khan. Hàn ống thủy phân
ở chân không. Thủy phân mẫu thử trong 24 giờ
ở 110 °C và trong chân không hoặc khí trơ để tránh
oxy hóa. Nếu lo ngại mẫu thử chưa được
thủy phân hoàn toàn, cần nghiên cứu kéo dài thêm thời
gian thủy phân (thí dụ trong 48 giờ và 72 giờ).
Thủy
phân pha hơi:
Đây là một trong các kỹ thuật thủy phân thông
dụng nhất được ưa dùng để làm vi
phân tích, khi chỉ có một lượng nhỏ mẫu
thử. Kỹ thuật này cũng cho phép giảm thiểu
việc mẫu thử bị nhiễm bẩn bởi dung dịch
thủy phân. Đặt ống thủy phân chứa mẫu
thử đã làm khô trong một ống thử to hơn,
ống này chứa một lượng thích hợp dung
dịch thủy phân và như vậy ngăn không cho mẫu
thử tiếp xúc trực tiếp với dung dịch
thủy phân. Hút chân không (áp suất thấp hơn 200 µm
thủy ngân hoặc 26,7 Pa), hoặc bơm một khí trơ
vào phần trên của ống thử. Hàn ống lớn và
thủy phân ở 110 ºC trong 24 giờ. Hơi acid sẽ
thủy phân mẫu thử và lượng acid ngưng
tụ trong ống thủy phân chứa mẫu thử là
tối thiểu. Sau khi thủy phân xong, sấy khô mẫu
thử trong chân không để loại bỏ acid dư
thừa.
Kỹ
thuật thủy phân 2
Giảm hiện tượng
oxy hóa tryptophan trong khi thủy phân bằng cách dùng acid
mercaptoethansulfonic (
Dung
dịch thủy phân: Dung dịch
Thủy
phân pha hơi:
Làm khô 1 - 100 µg mẫu thử protein/peptid trong ống
thủy phân. Đặt ống thủy phân trong một
ống lớn hơn, chứa khoảng 200 µl dung dịch
thủy phân. Hàn ống lớn trong chân không (áp suất
khoảng 50 µm thủy ngân hoặc 6,7 Pa). Thủy phân ở
170 - 185 °C trong khoảng 12,5 phút. Sau khi thủy phân xong làm khô
ống thủy phân ở chân không trong 15 phút để
loại acid dư thừa.
Kỹ
thuật thủy phân 3
Ngăn ngừa hiện tượng
oxy hóa tryptophan bằng dùng acid thioglycolic (TGA) làm acid khử.
Dung
dịch thủy phân: Dung dịch acid hydrocloric 7 M chứa 1% ,
10% acid trifluoroacetic và 20% acid
thioglycolic.
Thủy
phân pha hơi:
Làm khô từ 10 đến 50 µg mẫu thử protein/peptid
trong một ống thủy phân. Đặt ống thủy
phân trong một ống lớn hơn, chứa khoảng 200
µl dung dịch thủy phân. Hàn ống lớn trong chân không
(áp suất khoảng 50 µm thủy ngân hoặc 6,7 Pa).
Thủy phân mẫu thử ở 166 ºC trong khoảng 15 - 30
phút. Sau khi thủy phân xong, làm khô ống thủy phân trong
chân không trong 5 phút để loại acid dư thừa.
Lượng tryptophan tìm
thấy có thể phụ thuộc vào lượng mẫu
lấy thử.
Kỹ
thuật thủy phân 4
Oxy hóa cystein/cystin và methionin
bằng acid performic trước khi thủy phân mẫu
thử.
Dung
dịch oxy hóa:
Dùng acid performic mới pha bằng cách trộn đều 1
thể tích hydrogen peroxyd 30% (TT)
với 9 thể tích acid formic
khan (TT), rồi để ở nhiệt độ phòng
trong 1 giờ.
Tiến
hành:
Hòa tan mẫu thử protein/peptid trong 20 µl acid formic khan (TT) và để ở 50 ºC trong 5 phút.
Sau đó thêm 100 µl dung dịch oxy hóa. Để phản
ứng xảy ra trong 10 - 30 phút. Cystein sẽ chuyển thành
acid cysteic, còn methionin thành methionin sulfon. Ly tâm chân không để
loại thuốc thử thừa, rồi thủy phân
mẫu thử đã được oxy hóa theo kỹ
thuật 1 hoặc 2 nói trên. Kỹ thuật 4 này có thể
làm biến đổi tyrosin khi môi trường có muối halid.
Kỹ
thuật thủy phân 5
Oxy hóa cystein/cystin trong quá trình
thủy phân pha lỏng bằng natri azid.
Dung
dịch thủy phân: Thêm vào dung dịch acid hydrocloric 6 M có
chứa 0,2% phenol một lượng natri azid (TT) để có nồng độ 0,2%.
Phenol có trong dung dịch thủy phân ngăn ngừa sự
halogen hóa của tyrosin.
Thủy
phân pha lỏng: Thủy
phân mẫu thử protein/peptid ở 110 ºC trong 24 giờ.
Trong quá trình thủy phân, cystein/cystin trong mẫu thử
chuyển thành acid cysteic bởi tác dụng của natri azid
có trong dung dịch thủy phân. Kỹ thuật 5 này cho
kết quả tìm thấy của tyrosin tốt hơn
kỹ thuật 4 nhưng lại không định lượng
được methionin. Methionin chuyển thành hỗn
hợp của methionin với 2 dẫn chất oxy hóa là
methionin sulfoxid và methionin sulfon.
Kỹ
thuật thủy phân 6
Oxy hóa cystein/cystin bằng
dimethyl sulfoxid (DMSO) (TT)
Dung
dịch thủy phân: Thêm vào dung dịch acid hydrocloric 6 M (TT),
chứa 0,1% đến 1% phenol, một lượng DMSO để
được dung dịch nồng độ DMSO 2% (tt/tt).
Thủy
phân pha hơi:
Tiến hành thủy phân mẫu thử protein/peptid ở
khoảng 110 °C trong 24 giờ. Trong quá trình thủy phân,
cystein/cystin có trong mẫu thử sẽ bị DMSO có trong
dung dịch thủy phân chuyển thành acid cysteic. Để
hạn chế sự bất ổn định của
kết quả thu được và để chỉnh lý những
sai lệch do sự thủy huỷ từng phần, người
ta khuyên nên xác định kết quả tìm thấy acid
cysteic sau khi đã thủy phân oxy hóa các mẫu protein
chuẩn chứa từ 1 đến 8 mol cystein. Các hệ
số đáp ứng thu được từ các dung
dịch thủy phân protein/peptid thường thấp hơn
khoảng 30% so với hệ số đáp ứng thu được
từ các chuẩn acid cysteic không qua thủy phân.
Vì histidin, methionin, tyrosin và
tryptophan đều bị biến đổi nên kỹ
thuật 6 này không cho kết quả phân tích đầy đủ
thành phần cấu tạo của protein/peptid.
Kỹ thuật
thủy phân 7
Khử oxy và alkyl hóa
cystein/cystin bằng phản ứng pyridylethyl hóa ở pha hơi.
Dung
dịch khử:
Cho vào một bình thích hợp: 83,3 µl pyridin, 16,7 µl
4-vinylpyridin, 16,7 µl tributyl phosphin và 83,3 µl nước cất
rồi trộn đều.
Tiến
hành:
Cho vào ống thủy phân một lượng mẫu
thử protein/peptid (trong khoảng từ 1 - 100 µg). Đặt
ống thủy phân vào một ống lớn hơn đã có
sẵn dung dịch khử. Hàn kín ống lớn ở chân
không (áp suất khoảng 50 µm thủy ngân hoặc 6,7 Pa)
rồi làm nóng ở 100 °C trong 5 phút. Sau đó lấy ống
thủy phân ra, làm khô trong bình hút ẩm chân không trong 15 phút để
loại bỏ thuốc thử dư thừa. Cuối cùng
thủy phân mẫu thử đã được pyridylethyl
hóa, theo một trong các kỹ thuật thủy phân mô tả
ở trên. Song song, tiến hành pyridylethyl hóa trong cùng điều
kiện một mẫu chuẩn protein chứa 1 - 8 mol cystein
để xác định giá trị tìm thấy của
pyridylethyl cystein.
Chú
ý:
Việc kéo dài thời gian phản ứng pyridylethyl hóa
sẽ gây biến đổi các nhóm α-amino và ε – amino của
lysin có trong mẫu thử protein/peptid.
Kỹ
thuật thủy phân 8
Khử oxy và alkyl hóa
cystein/cystin bằng phản ứng pyridylethyl hóa ở pha
lỏng.
Các
dung dịch gốc: Pha chế và lọc 3 dung dịch trong
nước sau đây:
Dung dịch gốc A: Dung
dịch Tris-hydroclorid 1 M (pH 8,5) chứa 4 mM dinatri edetat.
Dung dịch gốc B: Dung
dịch guanidin hydroclorid 8 M
Dung dịch gốc C: Dung
dịch 2-mercaptoethanol 10%
Dung
dịch khử:
Pha hỗn hợp gồm 1 thể tích dung dịch gốc A
và 3 thể tích dung dịch gốc B để có dung
dịch đệm guanidin hydroclorid 6 M trong Tris-hydroclorid 0,25
M.
Tiến
hành:
Hòa tan khoảng 10 µg mẫu thử protein/peptid trong 50 µl dung
dịch khử, rồi thêm 2,5 µl dung dịch gốc C. Để
2 giờ ở nhiệt độ phòng, trong khí nitơ
hoặc argon và ở chỗ tối. Để thực
hiện phản ứng pyridylethyl hóa, thêm vào khoảng 2 µl
4-vinylpyridin và để yên 2 giờ trong tối, ở
nhiệt độ phòng. Sau đó, loại tạp bằng
cách tách bằng sắc ký lỏng cao áp pha đảo. Làm khô
mẫu thử protein/peptid sau khi qua sắc ký bằng ly tâm
chân không rồi tiến hành thủy phân bằng acid.
Kỹ
thuật thủy phân 9
Khử oxy và alkyl hóa cystein/cystin
bằng phản ứng carboxymethyl hóa ở pha lỏng.
Các
dung dịch gốc: Pha như ở kỹ thuật
thủy phân 8.
Dung
dịch carboxymethyl hóa: Dung dịch iodoacetamid 10% trong
ethanol 96%.
Dung
dịch đệm: Dùng dung dịch khử của kỹ
thuật thủy phân 8.
Tiến
hành:
Hòa tan mẫu thử protein/peptid trong 50 µl dung dịch đệm,
thêm khoảng 2,5 µl dung dịch gốc C. Bảo quản 2
giờ trong khí nitơ hoặc argon ở nhiệt độ
phòng và trong tối. Thêm một lượng dung dịch
carboxymethyl hóa gấp 1,5 lần tổng lượng các thiol
có trong mẫu thử theo lý thuyết. Nếu không biết
hàm lượng các thiol trong mẫu thử thì cứ 20
nanomol protein dùng 5 µl dung dịch iodoacetamid 100 mM. Để
tiếp 30 phút trong tối ở nhiệt độ phòng. Sau
đó thêm lượng dư 2-mercaptoethanol để
dừng phản ứng. Loại tạp và thu phần
protein/peptid bằng cách phân tách trên sắc ký lỏng pha đảo.
Làm khô phần protein/peptid thu được bằng ly tâm
chân không trước khi thủy phân bằng acid.
Trong quá trình thủy phân,
chất S-carboxyamidomethylcystein đã được
chuyển đổi thành S-carboxymethylcystein.
Kỹ
thuật thủy phân 10
Cystein/cystin tác dụng với
acid dithiodiglycolic hoặc acid dithiodipropionic để cho
một disulfid hỗn tạp.Tùy theo yêu cầu về độ
phân giải của kỹ thuật phân tích acid amin được
áp dụng mà chọn dùng acid dithiodiglycolic hoặc acid dithiodipropionic.
Dung
dịch khử:
Dung dịch acid dithiodiglycolic (hoặc acid dithiodipropionic) 1%
trong dung dịch NaOH 0,2M.
Tiến
hành:
Cho vào ống thủy phân khoảng 20 µg mẫu thử
protein/peptid. Thêm 5 µl dung dịch khử và 10 µl isopropanol. Ly
tâm chân không để loại pha lỏng rồi thủy
phân mẫu thử theo kỹ thuật thủy phân 1.
Kỹ thuật 10 này có lợi
là các thành phần acid amin khác trong mẫu thử không bị
ảnh hưởng của phản ứng và không cần
loại tạp trước khi thủy phân.
Kỹ
thuật thủy phân 11
Trong quá trình thủy phân
bằng acid, asparagin và glutamin được chuyển đổi
thành acid aspartic và acid glutamic tương ứng. Asparagin và
acid aspartic được biểu thị bằng một đại
lượng chung Asx, còn glutamin và acid glutamic bằng Glx. Trái
lại, khi thủy phân bằng acid với sự có mặt
của thuốc thử bis (1,1-trifluoroacetoxy) iodobenzen (BTI),
asparagin và glutamin bị tác dụng và chuyển tương
ứng thành acid diamiopropionic và acid diaminobutyric. Nhờ đó,
ta xác định được asparagin và glutamin trong
protein/peptid ngay khi có mặt của acid aspartic và acid glutamic.
Các
dung dịch khử: Pha chế và lọc 3 dung dịch sau:
Dung dịch A: Dung dịch acid
trifluoroacetic 10 mM.
Dung dịch B: Dung dịch
chứa guanidin hydroclorid 5 M và acid trifluoroacetic 10 mM.
Dung dịch C: Dung dịch
mới pha BTI 3,6% trong dimethylformamid.
Tiến
hành:
Cho vào một ống thủy phân sạch khoảng 200 µg
mẫu thử protein/peptid, 2 ml dung dịch A hoặc dung
dịch B và 2 ml dung dịch C. Hàn ống thủy phân trong
chân không. Để 4 giờ ở nhiệt độ 60 ºC
trong tối. Sau đó thẩm tách mẫu thử bằng nước cất để
loại bỏ thuốc thử dư thừa. Chiết
mẫu thử đã thẩm tách 3 lần bằng 3 thể
tích tương đương butyl acetat, rồi làm đông
khô.
Cuối cùng thủy phân
mẫu thử đông khô theo các kỹ thuật thủy phân
đã nói ở trên.
Các acid α,b-diaminopropionic
và α,g-
diaminobutyric đều không được phân giải rõ
ràng với lysin có trong mẫu thử, khi phân tách bằng
sắc ký trao đổi ion. Vì vậy, khi dùng sắc ký trao đổi
ion để tách các acid amin, hàm lượng của asparagin
và của glutamin có mặt trong mẫu thử được
xác định bằng hiệu số giữa hàm lượng
của acid aspactic và của acid glutamic tương ứng
thu được khi thủy phân acid không có BTI và hàm lượng
của acid aspartic và của acid glutamic tương ứng
thu được khi thủy phân có BTI.
Hàm lượng của threonin,
methionin, cystein, tyrosin và histidin có thể bị sai lệch
khi thủy phân bằng acid có BTI. Vì vậy, muốn có giá
trị đúng của các hàm lượng này, mẫu thử
phải được thủy phân bằng acid, không có
thuốc thử BTI.
Tách
và phát hiện các acid amin
Có nhiều kỹ thuật để
tách và phát hiện các acid amin; lựa chọn kỹ
thuật nào phụ thuộc vào yêu cầu về độ
nhạy của phép định lượng. Nhìn chung,
khoảng một nửa các phép phân tích acid amin dựa trên
việc tách thành acid amin tự do bằng sắc lý lỏng
trao đổi ion rồi tạo dẫn chất sau cột
phân tách. Kỹ thuật tạo dẫn chất sau cột có
thể áp dụng cho các mẫu thử có một lượng
nhỏ chất đệm (như các muối và urê) và thường
cần từ 5 µg đến 10 µg mẫu thử protein cho
một lần phân tích.
Các kỹ thuật còn lại,
bao gồm việc tạo các dẫn chất trước
cột rồi tách chúng bằng sắc ký lỏng cao áp pha đảo.
Các kỹ thuật tạo dẫn chất trước
cột rất nhạy và thường chỉ cần
từ 0,5 µg đến 1,0 µg mẫu thử protein/peptid cho
mỗi lần phân tích, nhưng lại có thể bị
ảnh hưởng bởi các muối đệm có trong
mẫu thử. Mặt khác, kỹ thuật tạo dẫn
chất trước cột còn có thể cho nhiều
dẫn chất khác nhau của cùng một acid amin, do đó
gây trở ngại cho việc biện giải kết
quả phân tích. So với kỹ thuật tạo dẫn
chất trước cột, thường kỹ thuật
tạo dẫn chất sau cột ít bị ảnh hưởng
bởi các biến thiên trong việc thực hiện phép định
lượng hơn.
Có thể dùng các kỹ
thuật sau đây để phân tích định lượng
các acid amin.
Thiết bị và thuốc
thử đều có sẵn trên thị trường. Hơn
nữa, hiện có nhiều cải tiến về các
mặt như pha chế thuốc thử, cách tiến hành phản
ứng, thiết bị sắc ký dùng trong các kỹ
thuật này, v.v.... Các thông số đặc trưng có
thể thay đổi tùy thuộc vào thiết bị đã
dùng và cách tiến hành phân tích. Nhiều phòng thí nghệm còn
áp dụng đồng thời nhiều kỹ thuật
chứ không chỉ một, để tận dụng
lợi ích của mỗi kỹ thuật đã áp dụng.
Trong các kỹ thuật sau đây, tín hiệu tương
tự được hiển thị trên máy ghi và diện
tích các pic được tích phân để định lượng.
Kỹ thuật 1: Tạo dẫn
chất sau cột với thuốc thử ninhydrin
Sắc ký trao đổi ion
tạo dẫn chất sau cột với thuốc thử
ninhydrin là một trong các kỹ thuật thông dụng
nhất để phân tích định lượng các acid
amin. Theo nguyên tắc, sắc ký trao đổi cation, dùng
lithi làm đối ion trong pha động được áp
dụng để phân tích các mẫu thử sinh học
phức tạp; trái lại, sắc ký trao đổi cation,
dùng natri làm đối ion trong pha động, nhanh hơn, được
dùng với các mẫu thử đơn giản hơn,
gồm hỗn hợp các acid amin đã được
thủy phân từ protein/peptid ra (tiêu biểu gồm 17 acid
amin khác nhau). Việc phân tích acid amin trên cột trao đổi
ion được thực hiện thông qua sự phối
hợp giữa thay đổi pH và thay đổi lực
ion của pha động (chương trình dung môi). Chương
trình nhiệt độ cũng thường được
áp dụng để tăng nhanh sự phân tách.
Các acid amin bậc nhất tác
dụng với ninhydrin cho hợp chất màu tím, hấp
thụ cực đại ở bước sóng 570 nm. Trái
lại, các acid amin bậc 2 (các imino acid) như prolin, tác
dụng với ninhydrin cho hợp chất màu vàng, hấp
thụ cực đại ở 440 nm. Vì vậy ta phát
hiện các dẫn chất của acid amin thu được
sau cột ở các bước sóng 440 và 570 nm.
Đối với đa
số các dẫn chất acid amin, giới hạn phát
hiện được xác định là 10 picomol; đối
với dẫn chất của prolin, giới hạn đó
là 50 picomol. Khoảng tuyến tính là 20 - 500 picomol, với
hệ số tương quan r > 0,999. Để có kết
quả tốt, dùng một lượng mẫu thử
lớn hơn 1 µg để thủy phân trước khi phân
tích các acid amin trong protein/peptid là thích hợp nhất.
Kỹ thuật 2: Tạo dẫn
chất sau cột với thuốc thử OPA
Thuốc thử
ortho-phthalaldehyd (OPA) tác dụng với các amin bậc
nhất, khi có mặt một hợp chất thiol, cho các
hợp chất isoindol phát huỳnh quang. OPA không tác dụng
với các amin bậc 2 (các imino acid như prolin) để
có hợp chất phát huỳnh quang; tuy nhiên, nếu oxy hóa
chúng bằng natri hypoclorid hoặc cloramin T thì phản
ứng với OPA sẽ xảy ra. Do đó, để phân
tích các acid amin trong mẫu thử protein/peptid bằng kỹ
thuật này, ta phải tách các acid amin tự do bằng
sắc ký trao đổi cation mạnh rồi oxy hóa sau
cột bằng natri hypoclorid hoặc cloramin T và tiếp đó
tạo dẫn chất phát huỳnh quang bằng thuốc
thử OPA với sự có mặt của một hợp
chất thiol như N-acetyl-L-cystein hoặc 2-mercaptoethanol. Các
acid amin bậc nhất không bị ảnh hưởng
bởi sự oxy hóa nói trên.
Việc tách các acid amin bằng
sắc ký lỏng trao đổi ion được thực
hiện nhờ sự phối hợp giữa việc thay đổi
pH và thay đổi lực ion của pha động (chương
trình dung môi). Sau khi được phân tách, các dẫn
chất phát huỳnh quang sẽ được phát hiện
với bước sóng kích thích ở 348 nm và bước
sóng phát quang ở 450 nm.
Giới hạn phát hiện được
xác định ở mức một vài chục picomol, đối
với đa số các dẫn chất OPA của acid
amin.Khoảng tuyến tính là từ vài picomol đến vài
chục nanomol. Để có kết quả phân tích tốt,
lấy mẫu thử protein/peptid lớn hơn 500 ng để
thủy phân.
Kỹ thuật 3: Tạo dẫn
chất trước cột với thuốc thử PITC
Thuốc thử phenylisothiocyanat
(PITC) tác dụng với các acid amin để thành dẫn
chất phenylthiocarbamyl (PTC) hấp thụ mạnh bức
xạ ở bước sóng 254 nm. Tách các chất PTC của
acid amin, đã được tạo trước cột,
bằng sắc ký lỏng cao áp pha đảo, dùng cột
octadecylsilyl (ODS) và phát hiện ở bước sóng 254 nm.
Việc phân tách các dẫn
chất acid amin bằng sắc ký lỏng cao áp pha đảo
được thực hiện nhờ việc phối
hợp giữa các thay đổi về nồng độ
acetonitril và về lực ion trong pha động.
Đối với đa
số các dẫn chất PTC-acid amin, giới hạn phát
hiện được xác định là 1 picomol. Khoảng
tuyến tính là 20 - 500 picomol với hệ số tương
quan r > 0,999. Để có kết quả phân tích tốt,
lấy lượng mẫu thử lớn hơn 500 ng để
thủy phân.
Chú ý: Sau khi đã loại
bỏ trong chân không thuốc thử dư, các dẫn
chất PTC-acid amin có thể bảo quản khô và đông băng
trong vài tuần lễ mà không có sự phân hủy nào đáng
kể. Nếu dung dịch để tiêm vào máy sắc ký được
bảo quản lạnh, sau 3 ngày cũng chưa thấy suy
giảm đáp ứng sắc ký nào đáng kể xảy ra.
Kỹ thuật 4: Tạo dẫn
chất trước cột với thuốc thử AQC
Thuốc thử
6-aminoquinolyl-N-hydroxysuccinimidyl carbamat (AQC) tác dụng với
các acid amin tạo thành các dẫn chất urê bất đối
xứng, ổn định, phát huỳnh quang (các dẫn
chất AQC-acid amin) và được phân tách bằng
sắc ký lỏng cao áp pha đảo. Do đó, ta tạo
dẫn chất AQC trước cột rồi tách chúng
bằng sắc ký lỏng cao áp pha đảo, dùng cột
ODS và phát hiện bằng detector huỳnh quang, ở bước
sóng kích thích 250 nm và bước sóng phát quang ở 395 nm.
Việc phân tách được thực hiện nhờ
việc phối hợp sự thay đổi nồng độ
acetonitril và thay đổi lực ion của pha động
(chương trình dung môi). Tiêm trực tiếp hỗn
hợp mẫu thử và thuốc thử vào máy sắc ký.
Không có nhiễu đáng kể gây ra bởi 6-aminoquinolin,
sản phẩm thứ cấp chủ yếu phát huỳnh
quang của thuốc thử. Thuốc thử dư được
thủy phân nhanh chóng (nửa đời < 15 giây) thành các
chất 6-aminoquinolin, N-hydroxysuccinimid và carbon dioxyd, và sau đó
1 phút, không còn phản ứng tạo dẫn chất xảy
ra.
Diện tích pic của các
dẫn chất AQC-acid amin không thay đổi chủ yếu
trong thời gian 1 tuần lễ, ở nhệt độ
phòng. Nhờ tính ổn định này, có thể tiến
hành phân tích qua đêm trên các máy tự động được.
Giới hạn phát hiện được
xác định ở vào khoảng từ 40 femtomol đến
320 femtomol, tính cho mỗi acid amin, trừ cystein. Giới
hạn phát hiện của cystein xấp xỉ bằng 800
femtomol. Khoảng tuyến tính là từ 2,5 đến 200
micromol, với hệ số tương quan r > 0,999. Có
thể thu được kết quả phân tích tốt
với lượng mẫu protein/peptid lấy thử
thấp tới 30 ng.
Kỹ thuật 5: Tạo dẫn
chất trước cột với thuốc thử OPA
Thuốc thử orthophthalaldehyd
(OPA), khi có mặt một hợp chất thiol (có thể dùng
2-mercaptoethanol hoặc acid 3-mercaptopropionic), sẽ tác dụng
với các amin bậc nhất để cho một hợp
chất isoindol phát huỳnh quang mạnh. Bản thân
thuốc thử OPA không phát huỳnh quang, nên không gây trở
ngại. Mặt khác, vì OPA dễ tan và ổn định
trong nước đồng thời cho phản ứng nhanh
nên có thể tạo dẫn chất và phân tích mẫu
thử một cách tự động, dùng thiết bị
tự nạp mẫu thử để
trộn lẫn mẫu thử với thuốc thử. Tuy
nhiên, OPA không cho phản ứng với các amin bậc 2, nên
kỹ thuật 5 này không áp dụng được để
phân tích các acid amin có hóa chức amin bậc 2 như prolin. Để
khắc phục, phải phối hợp kỹ thuật 5
này với kỹ thuật 7 hoặc 8 mô tả sau đây.
Vì dẫn chất OPA-acid amin
không bền vững nên sau khi tạo dẫn chất trước
cột, phải tiến hành phân tích ngay trên sắc ký
lỏng cao áp pha đảo và phát hiện kết quả
bằng detector huỳnh quang ở bước sóng kích thích
348 nm và bước sóng phát quang 450 nm.
Giới hạn phát hiện
bằng huỳnh quang thấp tới 50 femtomol đã được
báo cáo. Tuy nhiên, giới hạn phát hiện thực tế
của phép phân tích là 1 picomol.
Kỹ thuật 6: Tạo dẫn
chất trước cột bằng thuốc thử DABS-Cl
Thuốc thử
dimethylamino-azobenzensulfonyl clorid (DABS-Cl) là một thuốc
thử cho màu để phát hiện acid amin. Các dẫn
chất tạo thành (DABS-acid amin) rất bền vững và
hấp thụ cực đại ở bước sóng 436
nm. Tạo các dẫn chất này trước cột rồi
tách chúng bằng sắc ký lỏng cao áp pha đảo, dùng
cột ODS và phát hiện kết quả ở bước
sóng 436 nm.
Kỹ thuật này có thể
phân tích cả các acid amin bậc nhất và acid amin bậc
hai (như prolin) với cùng độ nhạy như nhau.
Còn có thể định lượng đồng thời
thành phần tryptophan có trong mẫu thử protein/peptid sau khi
đã thủy phân mẫu thử bằng các acid sulfonic như:
Acid mercaptoethansulfonic, acid p-toluensulfonic hoặc acid
methansulfonic như đã mô tả ở kỹ thuật
thủy phân 2 ở trên. Các thành phần khác dễ hỏng
vì acid như asparagin và glutamin cũng được phân tích
sau khi đã làm phản ứng chuyển đổi thành acid
diaminopropionic và acid diaminobutyric tương ứng bằng
phản ứng với thuốc thử BTI đã mô tả
ở kỹ thuật thủy phân 11 ở trên.
Trong kỹ thuật này, không
dùng norleucin nhân tạo để làm chuẩn nội, vì nó được
rửa giải ra tại vùng dày đặc các pic của các
acid amin bậc nhất trên sắc đồ. Có thể dùng
nitro -tyrosin làm chuẩn nội vì nó được rửa
giải ra tại vùng có ít pic trên sắc đồ.
Giới hạn phát hiện các
DABS-acid amin ở khoảng 1 picomol. Lượng nhỏ
từ 2 - 5 picomol của một DABS-acid amin nào đó cũng
có thể cho kết quả định lượng đáng
tin cậy, và chỉ cần dùng 10 - 30 ng protein thủy phân đã
được dẫn chất hóa cho mỗi lần phân
tích.
Kỹ thuật 7: Tạo dẫn
chất trước cột với thuốc thử FMOC-Cl
Thuốc thử 9-fluorenylmethyl
cloroformat (FMOC-Cl) tác dụng với acid amin bậc nhất
và acid amin bậc hai để tạo thành các dẫn
chất FMOC-acid amin phát huỳnh quang mạnh.
Phản ứng xảy ra
nhẹ nhàng trong môi trường nước, trong 30 giây. Các
dẫn chất được tạo thành đều
bền vững, chỉ riêng dẫn chất của histidin
là có biểu hiện phân hủy nào đó. Mặc dù bản
thân thuốc thử và các sản phẩm phụ của
phản ứng đều phát huỳnh quang nhưng ta có
thể loại chúng mà không làm mất mát các dẫn chất
FMOC-acid amin.
Sau khi tạo dẫn chất
trước cột, tiến hành tách các FMOC-acid amin bằng
sắc ký lỏng cao áp pha đảo, dùng cột ODS,
với chương trình gradient dung môi, biến thiên
tuyến tính từ hỗn hợp gồm 10 thể tích
acetonitril, 40 thể tích methanol và 50 thể tích đệm
acid acetic đến hỗn hợp gồm 50 thể tích
acetonitril, 50 thể tích đệm acid acetic. Phát hiện
kết quả bằng detector huỳnh quang ở bước
sóng kích thích 260 nm và bước sóng phát quang 313 nm. Có thể
phân tích được 20 dẫn chất acid amin trong vòng 20
phút.
Giới hạn phát hiện vào
cỡ femtomol. Đa số các acid amin có khoảng tuyến
tính từ 0,1 - 50 micromol.
Kỹ thuật 8: Tạo dẫn
chất trước cột bằng thuốc thử NBD-F
Thuốc thử
7-fluoro-4-nitrobenzo-2-oxa-1,3-diazol (NBD-F) tác dụng với
cả acid amin bậc nhất và acid amin bậc 2, ở
nhiệt độ 60 ºC, trong 5 phút, để cho các dẫn
chất NBD-acid amin phát huỳnh quang mạnh. Sau khi tạo
dẫn chất trước cột, tách chúng bằng
sắc ký lỏng cao áp pha đảo, dùng cột ODS và chương
trình gradient dung môi gồm acetonitril và hỗn hợp đệm
trong nước. 17 dẫn chất acid amin được
tách ra trong vòng 35 phút. Có thể dùng acid e-aminocaproic
làm chuẩn nội, vì được rửa giải ở
vùng ít pic trên sắc đồ. Phát hiện kết quả
bằng detector huỳnh quang, ở bước sóng kích thích
480 nm và bước sóng phát quang ở 530 nm.
Kỹ thuật này có độ
nhạy gần tương tự như độ nhạy
của kỹ thuật tạo dẫn chất trước
cột với thuốc thử OPA (kỹ thuật 5) đối
với các acid amin, trừ prolin không phân tích được
bằng kỹ thuật 5 vì không phản ứng với
thuốc thử OPA. Như vậy, kỹ thuật 8 này ích
lợi hơn kỹ thuật 5.
Giới hạn phát hiện
mỗi acid amin ở khoảng 10 femtomol và lượng
mẫu thử protein/peptid thủy phân cần lấy để
tạo dẫn chất trước cột ở khoảng
1,5 mg.
Tính
kết quả
Khi xác định hàm lượng
các acid amin trong một mẫu thử protein/peptid, cần
nhớ rằng, trong quá trình thủy phân bằng acid,
tryptophan và cystein bị phá hủy, serin và threonin bị phá
hủy một phần, valin và isoleucin không được
tách hoàn toàn, methionin có thể bị oxy hóa và một vài acid
amin như glycin và serin thường bị nhiễu.
Tiến hành phân tích ở môi trường chân không thích
hợp (áp suất thấp hơn 200 µm thủy ngân hoặc
26,7 Pa) hoặc ở môi trường có khí trơ (như
argon) khi thủy phân pha hơi, có thể giảm mức phân
hủy do bị oxy hóa. Các kết quả định lượng
cystein, tryptophan, threonin, isoleucin, valin, methionin, glycin và serin trong
một mẫu thử protein/peptid đã thủy phân có
thể thay đổi và do đó thường cần
tiến hành xem xét đánh giá bổ sung.
Tính tỷ
lệ phần trăm hàm lượng của một
loại acid amin có trong mẫu thử protein/peptid
Đó là số lượng
nanomol của một loại acid amin có trong 100 nanomol của
toàn thể các acid amin có trong mẫu thử protein/peptid.
Tỷ lệ này có ích trong việc đánh giá các dữ
liệu thu được khi phân tích các acid amin trong một
protein mà ta chưa biết khối lượng phân tử.
Nó giúp củng cố kết quả định tính một
protein/peptid chưa biết bằng cách so sánh tỷ lệ
phần trăm hàm lượng mỗi loại acid amin trong
mẫu thử chưa biết với tỷ lệ phần
trăm hàm lượng của mỗi loại acid amin tương
ứng có trong các protein/peptid đã biết.
Tính tỷ lệ phần trăm
hàm lượng của một acid amin trong protein/peptid theo
công thức sau:
![]()
Với ri = đáp ứng (hàm lượng)
tính theo nanomol của acid amin i.
rt = đáp ứng (hàm
lượng) tính theo nanomol của tất cả các acid amin
thu được trên sắc đồ.
Mẫu thử protein/peptid chưa
biết
Xác định khối lượng Qi
(tính theo microgam) của mỗi loại acid amin có mặt
trong mẫu protein/peptid chưa biết
Tính bằng công thức sau:
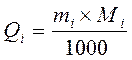
Với Qi = khối lượng
(tính theo microgam) của acid amin i có trong mẫu thử.
mi = hàm lượng
(tính theo nanomol) của tất cả các acid amin i tìm thấy
trên sắc đồ.
Mi = phân tử lượng
trung bình (tính theo gam) của acid amin i, đã được
chỉnh lý về khối lượng H2O bị
loại khi tạo thành liên kết peptit.
Ước lượng tổng
khối lượng của mẫu thử protein/peptid
Tổng khối lượng åQi
của các loại acid amin tìm thấy cho phép ta ước lượng
khối lượng của protein/peptid đem thử sau khi
đã chỉnh lý về khối lượng mất mát do có
sự phân hủy từng phần hoặc toàn phần
của một số acid amin dễ bị phân hủy trong
quá trình thủy phân.
Xác định số lượng
của mỗi loại acid amin tham gia cấu tạo mẫu
thử protein/peptid chưa biết. Nếu xác định
được phân tử lượng Mp của
protein/peptit đem thử (thí dụ bằng khối phổ),
ta tính số lượng của mỗi loại acid amin i
theo công thức sau:
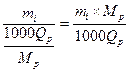
Với:
mi = hàm lượng
tính theo nanomol của acid amin i tìm thấy trong mẫu
thử
Qp = khối lượng,
tính theo microgam, của protein đem thử
Mp = phân tử lượng
của protein đem thử (tính theo gam)
Mẫu
thử protein/peptid đã biết phân tử lượng và
thành phần cấu tạo
Khi phân tích acid amin, một
số acid amin cho kết quả tìm thấy tốt, trái
lại, một số cho kết quả tìm thấy không
sử dụng được vì hoặc bị phân hủy
một phần hay toàn phần (ví dụ: Tryptophan, cystein,
threonin, serin, methionin), hoặc liên kết peptid không được
tách hoàn toàn (như liên kết của isoleucin, của valin),
hoặc bị nhiễu bởi một số acid amin tự
do (như bởi glycin và serin). Các acid amin cho kết quả tìm
thấy tốt điển hình là aspartat-asparagin,
glutamat-glutamin, alanin, leucin, phenylalanin, lysin và arginin. Danh sách
này có thể thay đổi tùy thuộc vào hệ thống
phân tích đã dùng. Các acid amin cho kết quả tìm thấy
tốt đại diện cho protein, do đó ta lợi
dụng chúng để xác định hàm lượng protein
và số lượng của mỗi loại acid amin (còn
gọi là thành phần của acid amin) có trong mẫu
thử.
Xác định hàm lượng protein
trong mẫu thử
Chia hàm lượng (tính theo
nanomol) của mỗi loại acid amin có giá trị tìm
thấy tốt cho số lượng dự đoán của
acid amin đó trong protein để có hàm lượng protein
tính theo loại acid amin đó. Tính giá trị trung bình của
tất cả các hàm lượng protein tính được theo từng loại acid amin có giá
trị tìm thấy tốt của mẫu thử. Các hàm lượng
protein tính theo từng loại acid amin riêng rẽ phải được
phân bố đồng đều xung quanh giá trị trung
bình của hàm lượng protein mới tính được
ở trên. Phải loại bỏ các giá trị hàm lượng
protein riêng rẽ của từng acid amin quá sai lệch
với giá trị trung bình đã tính được. Thường
các giá trị sai lệch quá 5% phải loại bỏ. Khi đó,
phải tính lại giá trị trung bình của hàm lượng
protein mới, dựa trên các giá trị còn lại (không
bị loại bỏ) của hàm lượng protein riêng
rẽ tính theo từng loại acid amin còn lại.
Xác định số lượng
của từng loại acid amin trong mẫu thử
Chia hàm lượng của
mỗi loại acid amin cho giá trị trung bình của hàm lượng
protein đã tính ở trên, ta được số lượng
của loại acid amin đó (tức thành phần acid amin)
trong mẫu thử.
Tính sai số tương đối
(theo tỷ lệ phần trăm) về thành phần trong
mẫu thử
Áp dụng công thức sau để
tính sai số tương đối về thành phần đối
với một loại acid amin i:
![]()
Với mi = hàm lượng,
tính theo nanomol, xác định bằng thực nghiệm,
của loại acid amin i có trong mẫu thử
mis = hàm lượng
(tính theo nanomol) đã biết của loại acid amin i có
trong mẫu thử
Giá trị sai số tương đối
trung bình
về thành phần của mẫu thử là giá trị trung
bình của tất cả các sai số tương đối
về thành phần tính theo từng loại acid amin riêng
rẽ, trừ tryptophan và cystein. Giá trị sai số tương
đối trung bình về thành phần của một
mẫu thử cung cấp thông tin quan trọng về độ
ổn định của phép phân tích theo thời gian. Sự
phù hợp giữa giá trị thành phần acid amin trong
mẫu thử, tìm thấy bằng thực nghiệm
với giá trị thành phần acid amin đã biết trước
của protein đem thử có thể giúp cho việc
củng cố kết quả định
tính và xác định độ tinh khiết của protein
trong mẫu thử